Los lípidos son moléculas orgánicas compuestas por carbono e hidrógeno. Son hidrofóbicas, osea insolubles en agua y si lo son en disolventes orgánicos.
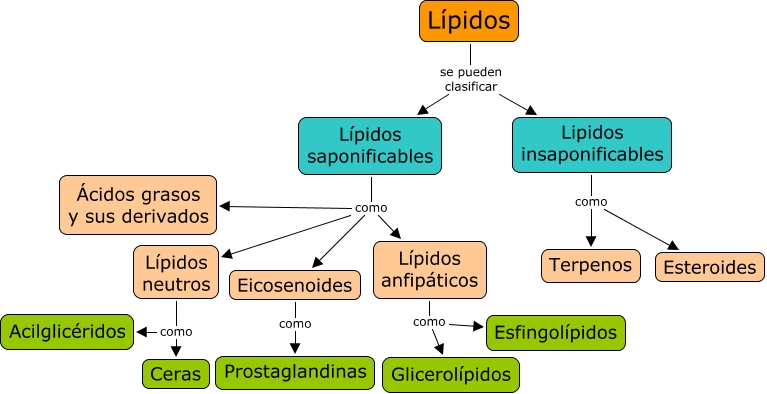
Son sustancias animales y vegetales que se pueden extraer con éter y que comprenden los ésteres saponificables y los no saponificables.
Funciones de los lípidos:
los lípidos tienen tres funciones primordiales: la primera es que son una fuente importante de energía para el organismo. segundo, los lípidos son los principales componentes de la membrana celular y finalmente desarrollan un papel importante en la señalización celular, bien sea como hormonas esteroideas o como mensajeros de la información de la superficie celular hacia el interior de ésta.
A continuación un mapa conceptual acerca de la clasificación de los lípidos que nos permitirá entender el tema de una forma mas clara.
los lípidos simples incluyen las grasas saturadas y las insaturadas (líquidos y ceras), tienen estructuras similares entre si y en su molécula solaente poseen carbono, hidrógeno y oxígeno. pueden ser de cadena corta mediana y larga. cuentan con una cadena hidrocarbonada no polar y una cabeza polar que es un grupo carboxilo.
LÍPIDOS: ACTUALIDAD.
a continuación les comparto algunos datos de los lípidos y sus usos en la actualidad:
- En la actualidad la parafina se obtiene del petróleo, pero con anterioridad, las velas las realizaban con ceras naturales, como la cera de abeja.
- la grasa de la leche y los aceites para ensaladas son grasas neutras.
- la lanolina se utiliza para fabricar lociones cosméticas para la piel.
- los triacilgliceroles en la antiguedad eran llamados triglicéridos.
ÁCIDOS NUCLÉICOS
los ácidos nucléicos tienen la función de transportar de información genética hereditaria, aunque todos cumplen con una función distinta.
 |
| flujo de la información genética. |
los ácidos nucléicos son macromoléculas que participan en el proceso de transferencia de la información genética entre generaciones celulares (ADN y ARN). están compuestos por bases nitrogenadas y una pentosa (desoxiribosa o ribosa)
BASES NITROGENADAS:
algunas tienen un anillo como la citocina y la timina, otras poseen dos anillos como la adenina y la guanina y reciben el nombre de pirimidinas y purinas respectivamente.
estas bases están unidas a su respectiva pentosa.
BASES NITROGENADAS:
algunas tienen un anillo como la citocina y la timina, otras poseen dos anillos como la adenina y la guanina y reciben el nombre de pirimidinas y purinas respectivamente.
estas bases están unidas a su respectiva pentosa.