EQULIBRIO DE DISOLUCIONES
Las reacciones que se presentan por un proceso espontáneo transcurren hasta un estado de equilibrio químico en el cuál la relación de concentración entre reactivos y productos es constante. Es el estado de un sistema en el que no se produce un cambio neto.
Durante el proceso, la energía libre disminuye hasta alcanzar un valor mínimo de equilibrio.
Un sistema en equilibrio no dejará de serlo de una forma espontánea, a menos de que uno de sus factores sea alterado, estos factores pueden ser la temperatura, la presión o la concentración, es decir, si alguno de los anteriores se varía, el equilibrio de la reacción también lo hará. El Principio de Le Chatelier explica estas variaciones del equilibrio, ya que dice que la posición del equilibrio químico siempre se desplaza en la dirección que tiende a compensar de la perturbación producida.
Cuando a y B reaccionan para formar C y D a la misma velocidad que C y D reaccionan para formar A y B, el sistema se encuentra en equilibrio.
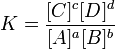 |
| expresión de la constante de equilibrio. |
IONIZACIÓN DEL AGUA.
La ionización es el proceso mediante el cuál se producen iones, que son las moléculas eléctricamente cargadas dada por la falta o el exceso de electrones en el medio.
El agua no es un líquido que sea químicamente puro, ya que contiene moléculas de hidronio, osea H3O+ (ó H+) y ión hidróxido OH– .
En el agua se presenta una leve tendencia que el átomo de hidrógeno salte del átomo de oxígeno con el que tiene una unión covalente al átomo de oxígeno con el que tiene un puente de hidrógeno en el que se producen los dos iones mencionados anteriormente.
 El pH es el término o medida utilizada en la ciencia especialmente en la química para indicar la acidez o alcalinidad de una solución. generalmente esta medida se toma en estado líquido.
El pH es el término o medida utilizada en la ciencia especialmente en la química para indicar la acidez o alcalinidad de una solución. generalmente esta medida se toma en estado líquido.
Arrhenius:
Ácido: Sustancia que en disolución acuosa libera iones de hidrógeno
Base: Sustancia que en disolución acuosa libera iones hidroxilo ()−OH
Brönsted y Lowry:
Ácido: Toda especie capaz de ceder protones.
Base: Toda especie capaz de aceptar protones.
Las sustancias que pueden actuar tanto como ácido como base, se llaman anfolitos, anfóteros o anfipróticos.
Lewis: propuso que no todas las reacciones ácido-base implican transferencia de protones, pero sin embargo forman siempre un enlace covalente dativo.
Ácido: Sustancia que puede aceptar un par de electrones de otros grupos de átomos, para formar un enlace covalente dativo.
Base: Sustancia que tiene pares de electrones libres, capaces de ser compartidos para formar enlaces covalentes dativos.
La escala va desde 0 (más ácido) a 14 (más básicos), 7 es neutro.La fórmula para hallar matemáticamente el pH es:
pH=-Log [H+]
El agua no es un líquido que sea químicamente puro, ya que contiene moléculas de hidronio, osea H3O+ (ó H+) y ión hidróxido OH– .
 |
| Ionización del agua. |
CONCEPTO DE pH
El término de pH proviene del latín pondus hidrogenii que quiere decir peso del hidrógeno, o potentia hidrogenni que quiere decir efectividad del hidrógeno.
 El pH es el término o medida utilizada en la ciencia especialmente en la química para indicar la acidez o alcalinidad de una solución. generalmente esta medida se toma en estado líquido.
El pH es el término o medida utilizada en la ciencia especialmente en la química para indicar la acidez o alcalinidad de una solución. generalmente esta medida se toma en estado líquido.Arrhenius:
 |
| Arrhenius |
Base: Sustancia que en disolución acuosa libera iones hidroxilo ()−OH
Brönsted y Lowry:
Ácido: Toda especie capaz de ceder protones.
Base: Toda especie capaz de aceptar protones.
Las sustancias que pueden actuar tanto como ácido como base, se llaman anfolitos, anfóteros o anfipróticos.
Lewis: propuso que no todas las reacciones ácido-base implican transferencia de protones, pero sin embargo forman siempre un enlace covalente dativo.
Ácido: Sustancia que puede aceptar un par de electrones de otros grupos de átomos, para formar un enlace covalente dativo.
Base: Sustancia que tiene pares de electrones libres, capaces de ser compartidos para formar enlaces covalentes dativos.
La escala va desde 0 (más ácido) a 14 (más básicos), 7 es neutro.
pH=-Log [H+]
AMORTIGUADORES DE pH
Las soluciones amortiguadoras son una mezcla de un ácido débil y su base conjugada.
Es una solución que puede absorber cantidades moderadas de ácidos o bases sin un cambio significativo en su pH, inhibiendo la efectividad de las concentraciones de hidrogeniones.
Estas soluciones tienen mucha importancia para la medicina ya que los niveles de pH en la sangre deben ser neutros para así evitar complicaciones en la salud.
Sinónimos: Buffer, tampón químico, solución amortiguadora.
Mediante la ecuación de Henderson-Hasselbach se puede calcular el pH de una mezcla amortiguadora si se conoce su composición.
se calcula sumando el pK del ácido mas el logaritmo de la relación [sal]/ [ácido].
Para saber más acerca del uso de esta ecuación puedes visitar la columna derecha que contiene videos interesantes acerca del tema.
 IMPORTANCIA FISIOLÓGICA DE LOS AMORTIGUADORES:
IMPORTANCIA FISIOLÓGICA DE LOS AMORTIGUADORES:
En el cuerpo se necesita cierto valor de pH que puede variar de órgano en órgano o líquido biológico para que la fisiología actúe de una manera adecuada, un ejemplo claro es el pH del estómago el cuál es muy ácido y es necesario para digerir las proteinas y otros alimentos, si hubiera un incremento, la digestión no se efectuaría correctamente.
Para saber más acerca del uso de esta ecuación puedes visitar la columna derecha que contiene videos interesantes acerca del tema.
 IMPORTANCIA FISIOLÓGICA DE LOS AMORTIGUADORES:
IMPORTANCIA FISIOLÓGICA DE LOS AMORTIGUADORES: En el cuerpo se necesita cierto valor de pH que puede variar de órgano en órgano o líquido biológico para que la fisiología actúe de una manera adecuada, un ejemplo claro es el pH del estómago el cuál es muy ácido y es necesario para digerir las proteinas y otros alimentos, si hubiera un incremento, la digestión no se efectuaría correctamente.
El pH apropiado de un compartimento biológico (estómago, sangre, jugo pancreático) permite que las moléculas esten cargadas electricamente o no como es el caso de la proteínas. También permitirá que las enzimas catalicen las reacciones correspondientes.
MACROMOLÉCULAS
AMINOÁCIDOS Y POLIPÉPTIDOS.
 Un aminoácido es una molécula orgánica con un grupo amino (-NH2) y un grupo carboxílico (-COOH). Son sustancias cristalinas, casi siempre de sabor dulce y con un carácter ácido además de poseer actividad óptica.
Un aminoácido es una molécula orgánica con un grupo amino (-NH2) y un grupo carboxílico (-COOH). Son sustancias cristalinas, casi siempre de sabor dulce y con un carácter ácido además de poseer actividad óptica.Los aminoácidos son las unidades elementales que constituyen las moléculas llamadas Proteínas.
Todos los aminoácidos componentes de las proteínas son alfa-aminoácidos, lo que indica que el grupo amino está unido al carbono alfa, es decir, al carbono contiguo al grupo carboxilo.
La unión de varios aminoácidos forman cadenas llamadas péptidos o polipéptidos.
Las proteínas son las moléculas mas diversas, complejas y de mayor tamaño en la célula. contienen hidrógeno, carbono, oxígeno, nitrógeno y usualmente azufre.
Algunas de las diversas funciones de las proteínas son:
- son catalizadores orgánicos (enzimas) de casi todas las reacciones de los sistemas biológicos.
- funcionan como hormonas transmitiendo información entre las células
- son transporte y almacenamiento de otras moléculas pequeñas
- funcionan como anticuerpos que proporcionan protección contra infecciones
- son componentes estructurales de las células y tejidos
- son reguladoras de expresión génica
ESTRUCTURA DE LAS PROTEÍNAS:
 |
| Tomada del Blog Todoesteoria.blogspot.com |
BIBLIOGRAFÍA
VERBAL: Clases de Bioquímica dictadas por el profesor Wilmer Soler Terranova
ESCRITA: Apuntes tomados en clase de bioquímica dictadas por el profesor Wilmer Soler Terranova - Macromoléculas, Aminoácidos, Polipéptidos
ONLINE:
Wikiversity-Equilibrio dinámico en disoluciones
Monografías-Equilibrio Químico
http://www.monografias.com/trabajos15/eCquilibrio-quimico/equilibrio-quimico.shtml#dEFIN
Universidad Nacional Virtual- Equilibrio Químico
http://www.virtual.unal.edu.co/cursos/ciencias/2000051/lecciones/cap01/06_13.htm
FisicaNet- Ionización del Agua
Universidad Nacional Virtual- Equilibrio Químico
http://www.virtual.unal.edu.co/cursos/ciencias/2000051/lecciones/cap01/06_13.htm
FisicaNet- Ionización del Agua
http://www.fisicanet.com.ar/biologia/introduccion_biologia/ap07_propiedades_del_agua.php
Profesor en Línea - Ionización del Agua
http://www.profesorenlinea.cl/Quimica/Agua_Ionizacion.html
Telepolis- pH
http://www.telepolis.com/cgi-bin/web/DISTRITODOCVIEW?url=/1489/doc/ph/ph.htm
Pce-Iberica- Definición del pH
http://www.pce-iberica.es/medidor-detalles-tecnicos/definicion-ph.htm
Quimicaisfd95 - Wikispaces-Soluciones amortiguadoras
http://quimicaisfd95.wikispaces.com/file/view/soluciones-buffer3729.pdf
Uco- Buffer
http://www.uco.es/organiza/departamentos/bioquimica-biol mol/pdfs/06%20pH%20AMORTIGUADORES.pdf
Profesor en Línea - Ionización del Agua
http://www.profesorenlinea.cl/Quimica/Agua_Ionizacion.html
Telepolis- pH
http://www.telepolis.com/cgi-bin/web/DISTRITODOCVIEW?url=/1489/doc/ph/ph.htm
Pce-Iberica- Definición del pH
http://www.pce-iberica.es/medidor-detalles-tecnicos/definicion-ph.htm
Quimicaisfd95 - Wikispaces-Soluciones amortiguadoras
http://quimicaisfd95.wikispaces.com/file/view/soluciones-buffer3729.pdf
Uco- Buffer
http://www.uco.es/organiza/departamentos/bioquimica-biol mol/pdfs/06%20pH%20AMORTIGUADORES.pdf